靶向蛋白质降解(TPD)是通过诱导E3泛素连接酶与靶向蛋白质之间的接近,从而促进靶向泛素化及后续的蛋白酶体降解。这种机制作为一种新兴的治疗工具,对于处理致病蛋白展现出巨大潜力。TPD的实现主要依赖于两种方法:一种是使用蛋白质降解靶向嵌合体(PROTACs),这些双功能化合物分别与靶标和E3连接酶结合;另一种是利用单分子胶来结合连接酶或靶标。
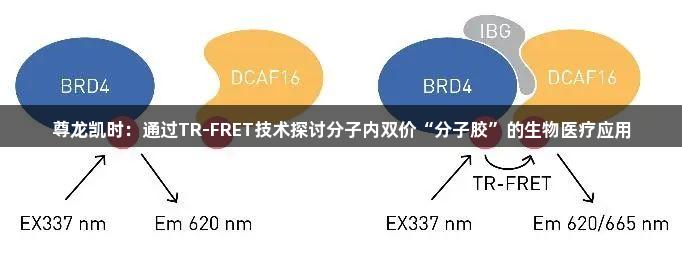
本文着重介绍了一种新型的BRD4双功能降解剂——分子内双价粘合剂(Intramolecular Bivalent Glues, IBGs)的作用机制。与PROTACs以trans构象连接目标蛋白和E3连接酶不同,IBGs通过cis构象同时连接目标蛋白的两个相邻结构域,从而增强与E3连接酶表面的互补性。这种构象变化利用了目标蛋白与连接酶之间的天然亲和力,将BRD4“粘”附在E3连接酶DCAF16上,从而促进BRD4的降解。
通过对BRD4–IBG1–DCAF16三元复合物的结构解析,研究进一步指导了更高效降解剂的理性设计,其效力可达低皮摩尔级别。利用时间分辨荧光共振能量转移(TR-FRET)分析,评估了BRD4与DCAF16之间的三元复合物形成。该分析使用了针对BRD4的铕标记抗体及Cy5标记的DCAF16,证明了IBG分子能够引导标记的BRD4与DCAF16之间形成有效的复合物。
在TR-FRET实验中,Cy5标记的DCAF16、His-BRD4及抗His铕标记供体均在TR-FRET缓冲液中配制。进行两类TR-FRET实验:第一类是梯度滴定IBGs加入BRD4和Cy5-DCAF16的混合物,第二类则是滴定Cy5-DCAF16加入BRD4或BRD4与IBG的混合物。
本研究的主要目标是体外表征DCAF16、BRD4与IBG1之间的相互作用。通过等温滴定量热法(ITC)观察到IBG1、DCAF16与BRD4 Tandem形成了三元复合物。同时,TR-FRET的复合物形成分析表明,IBG1在滴定条件下,BRD4 Tandem与DCAF16之间以剂量依赖的方式形成复合物。
进一步的TR-FRET稳定性分析确认,在IBG1存在时,滴定的DCAF16与BRD4 Tandem之间的复合物形成(Kd=712nM)。尽管在未添加IBG1的情况下也观察到DCAF16与BRD4 Tandem之间的内在亲和力(Kd=1μM),但这种亲和力在单独的BRD4 BD1或BD2结构域中并未显现,表明需协同作用才能形成复合物。
ITC对比分析显示,在IBG1存在时,DCAF16与BRD4 Tandem之间的亲和力显著增强(Kd下降至06μM),同时相互作用的热力学特性也有所改变。
经过对IBG1作用机制的确认研究,新的化合物IBG3被合成,以增强对BRD4和DCAF16的分子胶合活性。IBG3在降解BRD4方面表现优于IBG1,降解效率达到了低皮摩尔水平(DC50=67pM)。在TR-FRET实验中,IBG3对BRD4-DCAF16复合体的结合能力也有所提升(EC50=32nM)。
总体来看,IBG3相较于其前体化合物表现出对BRD2和BRD4的更高特异性,主要作用于串联溴结构域而非孤立结构域,并且作用机制依旧通过DCAF16介导。这表明其降解机制仍然通过分子内“胶合作用”实现。
综上所述,通过TR-FRET分析方法,本文展示了一种新型的BRD4-DCAF16分子胶。IBGs通过同时结合目标蛋白的两个结构域,显著增强其与E3连接酶的亲和力,形成了新的相互作用模式。这一策略为靶向多种效应蛋白、重构细胞信号通路以及实现蛋白降解等提供了开阔的药理学探索路径,为生物医疗领域带来了新的希望,**尊龙凯时**将继续在这一领域中探索更有效的解决方案。


